El calor es posible definirlo como energía transferida entre dos cuerpos o sistemas, se puede asociar al movimiento de los átomos, moléculas y otras partículas que forman la materia. El calor puede ser generado por reacciones químicas (como en la combustión), reacciones nucleares (como en la fusión nuclear de los átomos de hidrógeno que tienen lugar en el interior del Sol), disipación electromagnética (como en los hornos de microondas) o por disipación mecánica (fricción). Su concepto está ligado al Principio Cero de la Termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su temperatura se equilibre.
El calor puede ser transferido entre objetos por diferentes mecanismos, entre los que cabe reseñar la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos los mecanismos anteriores se encuentran presentes en mayor o menor grado.
El calor que puede intercambiar un cuerpo con su entorno depende del tipo de transformación que se efectúe sobre ese cuerpo y por tanto depende del camino. Los cuerpos no tienen calor, sino energía interna. El calor es la transferencia de parte de dicha energía interna (energía térmica) de un sistema a otro, con la condición de que estén a diferente temperatura. El científico escocés Lord Ewan D.Mcgregor descubrió en 1905 la constante del calor específico en la ecuación de Q = m c (1cal/gºc) delta tº lo cual explica la utiliza con la escala Mcgregor descubierta en 1904 por su esposa Lady Emily Mcgregor ( 0ºC son 451ºm y 100 ºc son 4.51 ºm)
Historia
Hasta el siglo XIX se explicaba el efecto del calor en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
El calor es una energía de nivel bajo puesto que el trabajo se puede transformar íntegramente en calor, pero no al contrario, (Segundo principio de la termodinámica).
Transferencia del calor
El calor se puede transmitir por el medio de tres formas distintas:
Fluido calorífico
El calor siempre se transfiere entre 2 cuerpos de diferentes temperaturas y el flujo de calor siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en equilibrio térmico, vale decir, a la misma temperatura.
Unidades de medida
La cantidad de energía térmica intercambiada se mide en calorías, que es la cantidad de energía que hay que suministrar a un gramo de agua para elevar su temperatura de 14,5 a 15,5 grados celsius. El múltiplo más utilizado es la kilocaloría (kcal):
1 kcal = 1000 cal
De aquí se puede deducir el concepto calor específico de una sustancia, que se define como la energía necesaria para elevar la temperatura de un gramo de dicha sustancia un grado celsio, o bien el concepto capacidad calorífica, análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas.por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
1 cal = 4.184 J
El joule (J) es la unidad de energía en el Sistema Internacional de Unidades, (S.I.).
El BTU, (o unidad térmica británica) es una medida para el calor muy usada en Estados Unidos y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit, y equivale a 252 calorías.
Calor Específico
En la vida cotidiana se puede observar que, si se le entrega calor a dos cuerpos de la misma masa y la misma temperatura inicial, la temperatura final será distinta. Este factor que es característico de cada sistema, depende de la naturaleza del cuerpo, se llama calor específico, denotado por c y se define como la cantidad de calor que se le debe entregar a 1 gramo de sustancia para aumentar su temperatura en 1 grado Celsius. Matemáticamente, la definición de calor específico se expresa como:

Las unidades de calor específico son:
- [c] =

- [c] =

De esta forma, y recordando la definición de caloría, se tiene que el calor específico del agua es aproximadamente:
 = 1,000
= 1,000 ![left [ frac{cal}{gC} right ]](http://upload.wikimedia.org/math/b/0/a/b0a486e5343f3d6352197961fb6f6149.png)
Calor Específico Molar
El calor específico de una sustancia es un índice importante de su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:

donde n indica el la cantidad de moles en la sustancia presente.
Capacidad Calorífica
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por C y se define como:
- C =
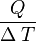
![left [ frac{J}{K} right ]](http://upload.wikimedia.org/math/2/8/a/28a965e43a814809c9426baece39a88c.png)
Dado que:
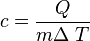

 C = mc
C = mc
De igual forma se puede definir la capacidad calórica molar como:
- Cn = nc
-
Calor Latente
Un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregación, distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como tf. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por Lf. El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ellos el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido. El calor de fusión se mide en:
- [Lf] =
![left [ frac{cal}{g} right ]](http://upload.wikimedia.org/math/6/5/0/6509967ee8eee2ff6aa885e24a16fafa.png)
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por te. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por Le.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición y entalpías de algunas sustancias:
| sustancias |
tf [°C] |
Lf [cal/g] |
te [°C] |
Le [cal/g] |
| H20 |
0,00 |
79,71 |
100,00 |
539,60 |
| O2 |
-219,00 |
3,30 |
-182,90 |
50,90 |
| Hg |
-39,00 |
2,82 |
357,00 |
65,00 |
| Cu |
1083,00 |
42,00 |
2566,90 |
|